فام و همکاران (2023) از دادههای مربوط به تصمیمات نظارتی و ارزیابیهای فناوری سلامت (HTAs) در استرالیا، کانادا و بریتانیا استفاده میکند و آنها را با داروهایی که توسط FDA در ایالات متحده تأیید شده است مقایسه میکند. آنها متوجه می شوند که:
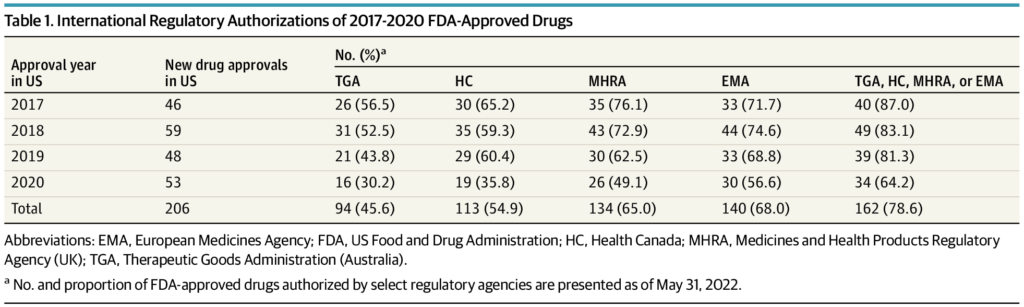
FDA 206 داروی جدید را در سال 2017 تا 2020 تأیید کرد که از این تعداد 162 (78.6٪) مجوز بازاریابی توسط حداقل 1 آژانس نظارتی دیگر با تاخیر متوسط (IQR) 12.1 (17.7) ماه پس از تأیید ایالات متحده صادر شد. در مقابل، 5 داروی مورد تایید FDA به دلیل ارزیابی نامطلوب سود به خطر، مجوز بازاریابی توسط یک آژانس نظارتی بینالمللی را رد کردند. 42 داروی مورد تایید FDA دیگر توصیههای بازپرداخت منفی از آژانسهای HTA در استرالیا، کانادا یا بریتانیا دریافت کردند که دلیل آن مشخص نبودن مزایای بالینی یا قیمتهای غیرقابل قبول بالا بود. هزینه متوسط (IQR) ایالات متحده برای 47 دارویی که مجوز آنها را رد کرده یا برای بازپرداخت آنها توسط آژانس بین المللی توصیه نمی شود، 115281 دلار (166690 دلار) برای هر بیمار در سال بود. 20 دارو برای نشانه های انکولوژی بودند و 36 دارو توسط FDA از طریق مسیرهای نظارتی تسریع شده یا قانون داروهای یتیم تأیید شدند.
مقاله کامل است اینجا.