برای بیماران مبتلا به بیماری های جدی، دسترسی به داروهای موثر در جدول زمانی بسیار مهم است. آژانس دارویی اروپا (EMA) تا حدی برای کمک به تسریع در تأیید داروها و اطمینان از صرفهجویی و مؤثر بودن این محصولات ایجاد شد. همانطور که در مقاله ای توسط گرونوالد و استارگارد (2024) بیان شد:
EMA [European Medicines Agency] در سال 1995 اساساً برای هماهنگ کردن مجوز بازاریابی داروها در اتحادیه اروپا و منطقه اقتصادی اروپا تأسیس شد … زیرا تفاوت های اساسی بین کشورهای اروپایی از نظر تاخیر در عرضه و در دسترس بودن داروها وجود داشت.
EMA دارای 3 رویه اجتماعی کلیدی بود که امکان دسترسی به بازارهای برخی یا همه کشورهای عضو اتحادیه اروپا را به طور همزمان فراهم می کرد.
- رویه متمرکز (CP). اگر EMA یک دارو را ارزیابی کند و مجوز بازاریابی به آن بدهد، این تصمیم برای همه کشورهای عضو اتحادیه اروپا الزام آور است. CP در سال 1995 معرفی شد و در اصل فقط برای “فرایندهای بیوتکنولوژیکی، مانند آنتی بادی های مونوکلونال، بیان ژن کنترل شده یا فناوری DNA نوترکیب” استفاده می شد. فهرست درمانهایی که تحت CP ارزیابی شدهاند، شامل داروها و مواد ضد سرطان، دیابت، و اچآیوی/ایدز (در سال 2005)، بیماریهای ویروسی و بیماریها/اختلالات خودایمنی (در سال 2008)، و محصولات دارویی پیشرفته (مثلاً، سلول و ژن درمانی) نیز در سال 2008.
- روش شناسایی متقابل (MRP). در این مورد، ارزیابی توسط یک کشور عضو مرجع انجام می شود که متقاضی می تواند آزادانه آن را انتخاب کند و تصمیم آن متعاقباً توسط سایر کشورهای عضوی که متقاضی به دنبال دسترسی به بازار هستند، اتخاذ می شود. این روش در سال 2001 اتخاذ شد و شامل درمان های جدیدی است که خارج از CP هستند مانند سایر داروها و ژنریک ها.
- رویه غیرمتمرکز (DCP). این مورد که در سال 2005 تصویب شد، به تولیدکنندگان دارو اجازه میدهد تا به دنبال تاییدیه کشور به کشور باشند. این فقط برای مواد جدیدی که تحت کنترل CP یا MRP نیستند واجد شرایط است.
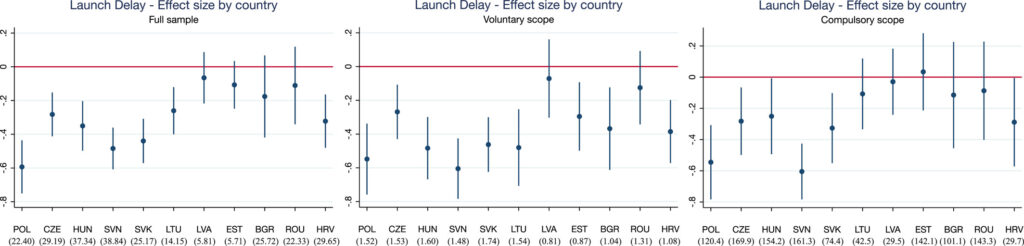
برای بررسی تأثیر این رویهها، گرونوالد و استارگارد (2024) تجزیه و تحلیل تفاوتها در تفاوتها را انجام میدهند و کشورهایی را که مشمول این رویههای اجتماعی میشوند با آنهایی که نیستند مقایسه میکنند. به طور خاص، با گسترش اتحادیه اروپا، در سال 2004 جمهوری چک، استونی، مجارستان، لتونی، لیتوانی، لهستان، اسلواکی و اسلوونی (قبرس و مالت نیز در این تاریخ به اتحادیه اروپا پیوستند اما نویسندگان اطلاعاتی از این کشورها نداشتند). در سال 2007، بلغارستان و رومانی به اتحادیه اروپا پیوستند و سپس کرواسی در سال 2013 به اتحادیه اروپا پیوستند. در مقابل، بلاروس، بوسنی و هرزگوین، قزاقستان، روسیه، صربستان، سوئیس و ترکیه هرگز به اتحادیه اروپا نپیوستند. با استفاده از دادههای فروش IQVIA از 33 کشور اروپایی، نویسندگان (1) تاخیر عرضه و (2) در دسترس بودن مواد فعال جدید را بررسی کردند. نویسندگان دریافتند که
…کشورها میانگین کاهش تاخیر پرتاب 10.9 ماهه را تجربه کردند (پ = 0.004) پس از پیوستن به اتحادیه اروپا. اثرات در میان داروهایی که متعلق به نشانههایی هستند که ممکن است داوطلبانه در CP شرکت کنند، اما ملزم به انجام آن نیستند، بیشتر بود. اینها اغلب از نظر مالی برای تولیدکنندگان جذابیت کمتری نسبت به داروها در محدوده اجباری دارند. در دسترس بودن داروهای جدید راه اندازی شده بدون تأثیر باقی ماند. ما نشانههایی پیدا کردیم مبنی بر اینکه بزرگی اثر خاص کشور مجوز بازاریابی متمرکز بر تأخیر راهاندازی ممکن است تحت تأثیر تصمیمهای استراتژیک تولیدکنندگان در سطح ملی باشد (مثلاً تجارت موازی یا قیمتگذاری مرجع).
برای جزئیات بیشتر، می توانید مقاله کامل را مطالعه کنید اینجا.